“Gli aminoacidi nell’organismo hanno molteplici ruoli, quindi è ovvio che ricondurli alla “semplice” funzione plastica, limita molto la comprensione olistica dei loro effetti”.
Gli aminoacidi compongono le proteine e le proteine sono biomolecole presenti nell’organismo ed a loro volta sono la struttura di ormoni, enzimi, anticorpi, molecole segnale, glicoproteine e lipoproteine con glucidi e lipidi ed altro…
Ciò non può però giustificare un eccesso proteico esogeno (mangiare proteine in abbondanza a cazz…):- “perché tanto l’organismo con gli aminoacidi ci fa di tutto, quindi più GH, più igf-1, più insulina, più enzimi digestivi, un sistema immunitario più forte ecc…
L’organismo degli animali non ha riserve di azoto e quindi l’eccesso va smaltito, sempre e comunque (non pensate che valga solo per i sedentari).
Essendo che l’azoto è l’elemento che rende gli aminoacidi tali, è necessario soffermarsi sul suo ruolo biochimico.
RUOTA TUTTO INTORNO ALL’ AZOTO
(utilizzo per le biosintesi ed escrezione)
L’azoto organico è una risorsa preziosa per tutti gli organismi che non possono fissarlo dall’atmosfera o che non possono ottenerlo dai nitriti e nitrati provenienti dal terreno (solo gli organismi vegetali ed alcuni batteri possono farlo).
Mentre glucidi e lipidi vengono utilizzati prevalentemente a scopo energetico, i nutrienti provenienti dal metabolismo delle proteine vengono utilizzati per la sistesi di altri composti azotati.
Sostanzialmente attraverso il procedimento di trasferimento dell’azoto da un aminoacido su un accettore definito α-chetoacido, si ottiene un altro aminoacido.
Il fulcro della questione sull’essenzialità degli aminoacidi è proprio questo. L’organismo dispone solo di determinati α-chetoacidi
precursori, dalla quale può sintetizzare solo la metà dei 20 aminoacidi, mentre tutti gli altri devono essere introdotti dalla dieta, essendo che la sistesi proteica necessita la disponibilità di tutti e 20 gli aminoacidi che vi concorrono.
Arginina, aspartato e glutammato possono essere sintetizzati attraverso il trasferimento dell’azoto sul α-chetoacido. La prolina può essere sintetizzata dal glutammato, glicina e cisteina dalla serina e la tirosina può derivare dalla fenilalanina. Per questo motivo questi sono considerati aminoacidici non essenziali.
I processi fondamentali per il metabolismo degli aminoacidi avvengono prevalentemente nel fegato, dove gli aminoacidi in eccesso vengono utilizzati per le biosintesi o degradati. L’azoto che deriva dalla degradazione degli aminoacidi viene trasformato in urea ed eliminato con le urine.
I trasportatori del gruppo aminico (sarebbe l’azoto degli aminoacidi legato ad atomi di idrogeno) al fegato sono gli amminoacidi glutammina e alanina.
Nelle cellule epatiche il gruppo aminico di questi due aminoacidi viene distaccato (deaminazione) ottenendo glutammato e ammoniaca. L’ammoniaca è tossica per le cellule e quindi l’azoto che la compone viene utilizzato per la sintesi dell’urea, un composto atossico, solubile e per questo facilmente trasportabile nel sangue.
L’assorbimento e l’utilizzo degli aminoacidi che arrivano dalla vena porta del fegato dipende dalla quantità di proteine introdotte. Questo organo assume quote maggiori di aminoacidi in proporzione alla loro concentrazione nel sangue portale.
Altri organi come ad esempio i muscoli, sono in grado di metabolizzare direttamente gli aminoacidi a catena ramificata e la (leucina, valina, isoleucina e treonina), utilizzando gli scheletri carboniosi per la prodiuzione di energia e servendosi di alanina e glutammina per trasportare il gruppo aminico al fegato per il riutilizzo o lo smaltimento.
L’intestino metabolizza elevate quantità di glutammina ricevuta dalla circolazione e di glutammato derivato dalla digestione delle proteine. Gli enterociti (cellule intestinali con funzione assorbente) utilizzano glutammina e glutammato sia a scopo energetico, che per sintetizzare arginina, prolina e glutatione.
Le quote di glutammina e glutammato assorbiti dagli enterociti, ma non metabolizzati, raggiungono il fegato attraverso la vena porta.
Il sistema nervoso smaltisce l’ammoniaca sintetizzando glutammina dal glutammato utilizzando ATP.
Nei reni la glutammina viene convertita in glutammato producendo bicarbonato, che viene riassorbito nel sangue incrementando la riserva alcalina.
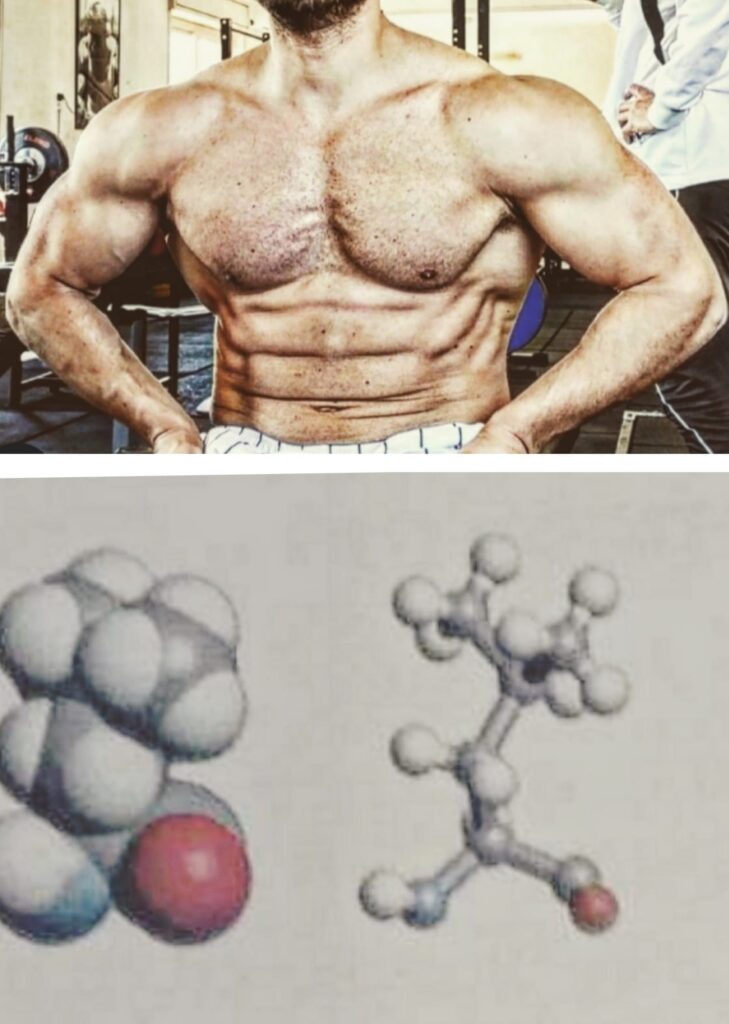
Prima di continuare, per non amplificare lo stato confusionario che un non addetto ai lavori potrebbe avvertire leggendo, occorre che spieghi brevemente e semplicemente come è strutturato un aminoacido a livello chimico.
STRUTTURA DEGLI AMINOACIDI
La chimica organica si basa sullo studio di tutti i composti contendenti carbonio che fanno parte della struttura degli elementi della vita. Il carbonio grazie ad una specifica caratteristica dovuta alle particelle che compongono questo atomo, è in grado di formare quattro legami con altri elementi chimici.
Questi legami possono essere singoli, doppi e tripli, a seconda che il carbonio si leghi a quattro, tre o due elementi.
Un aminoacido è una biomolecola che possiede un carbonio “principale”, definito carbonio chirale, legato a quattro atomi diversi, tra cui un atomo di carbonio (gruppo carbossilico), un atomo di idrogeno, un secondo atomo di carbonio a cui è legata una struttura specifica definita insieme ad esso gruppo R, e l’azoto.
Il carbonio del gruppo carbossilico (chiamato così perché fa parte dei gruppi funzionali) è fondamentale perché con l’azoto di un altro aminoacidico forma il legame peptidico da cui derivano la struttura primaria delle proteine e tutti i dipeptidi, tripeptidi ed oligopeptidi che sentiamo nominare…
FABBISOGNO PROTEICO
Nell’organismo umano, considerando una persona adulta ed in salute, ogni giorno vengono degradati ad amminoacidi circa 300-400 g di proteine ed una quantità simile di aminoacidi viene incorporata nel processo di biosintesi delle proteine.
Si chiama equilibrio, ma per riequilibrare le perdite di azoto, poiché i processi catabolici eccedono quelli catabolici, è necessario introdurre almeno 30 g di proteine al giorno.
Quindi per logica basterebbero 30 g oltre il fabbisogno per alimentare la crescita, ma a quanto ammonta il fabbisogno?
La quantità ottimale si attesta intorno alle 50-100 g, ma un giovane culturista in fase di accrescimento dei suoi tessuti muscolari potrebbe anche avere un fabbisogno maggiorato.
E allora se il fabbisogno è di cento grammi, 120-150 g è già una quantità più che ottimale.
AMINOACIDI UTILIZZATI PER SCOPI ENERGETICI ATTRAVERSO IL RECUPERO DEL CARBONIO
Nell’uomo non esistono riserve di proteine, quindi il catabolismo degli amminoacidi è finalizzato al recupero dello sceletro carbonioso ed all’eliminazione dell’ammoniaca nel ciclo dell’urea. Gli scheletri carboniosi dei 20 aminoacidi danno origine a sette prodotti catabolici diversi. Cinque prodotti sono definiti glucogenici e gli altri due chetogenici.
Dei glucogenici quattro sono intermedi del ciclo di Krebs e sono ossalacetato, fumarato, α-chetoglutarato e succinil-CoA ed il quinto, il piruvato, può essere convertito ad ossalacetato.
Di conseguenza gli aminoacidi che perdendo il gruppo aminico danno luogo alla produzione di questi metaboliti, vengono definiti glucogenici.
La gluconegenesi è il processo endoergonico che per avvenire consuma ATP.
Si tratta della produzione endogena di glucosio a partire da substrati non glucidici ed avviene in prima fase nel mitocondrio delle cellule epatiche.
Tutti i composti descritti, come il piruvato, conducono alla formazione di ossalacetato, molecola che può uscire dal mitocondrio utilizzando specifici sistemi navetta e raggiungere il citosol dove ripercorrendo inversamente le tappe delle glicolisi, diventa glucosio.
Gli altri due prodotti metabolici sono acetoacetato e acetilCoA, che possono essere utilizzati per la sintesi dei corpi chetonici, degli acidi grassi e del colesterolo.
Di tutti gli aminoacidi, solo lisina e leucina sono puramente chetogenici, mentre tirosina, fenilalanina, isoleucina, treonina e triptofano sono sia glucogenici che chetogenici.
RISPARMIO DEGLI AMINOACIDI IN CONDIZIONI METABOLICHE DI EMERGENZA
Le proteine facenti parte del tessuto muscolare porrebbero essere utilizzate come riserva energetica (catabolismo estremo) per il muscolo in condizioni emergenziali, infatti gli aminoacidi possono essere resi disponibili mediante idrolisi delle proteine stesse.
Tuttavia a causa delle scarse rese energetiche e delle negative ripercussioni sull’efficienza fisica dell’organismo, le proteine non vengono normalmente utilizzate per sostenere l’attività muscolare.
Pertanto soltanto digiuni molto prolungati associati ad intensa attività muscolare provocano degradazione delle proteine per scopi energetici, poiché muscolo e fegato in condizioni di riposo prediligono i più efficienti metaboliti di derivazione lipidica.
AMINOACIDI E INSULINA
L’insulina è un ormone composto da una catena di aminoacidi (guarda caso), nello specifico è costituita da due catene peptidiche rispettivamente di 21 aminoacidi (catena A) e 18 aminoacidi (catena B).
Le due catene sono collegate da un ponte disolfuro, che sarebbero due atomi di zolfo legati tra loro ed all’aminoacido cisteina delle due catene proteiche dell’ormone.
Il complesso insulina-recettore attiva nel citosol la proteina substrato dell’insulina (IRS) che sviluppa diverse risposte della cellula bersaglio.
Tra queste, oltre alla conosciuta ritenzione di glucosio e sintesi di glicogeno da parte della cellula, vi è anche l’attivazione delle sintesi proteiche che regolano la trascrizione di geni.
Tutti sanno che è necessario un incremento della glicemia nel sangue per promuovere la secrezione d’insulina da parte delle cellule β del pancreas. È corretto, ma non è l’unica strada percorsa dall’organismo.
L’incremento plasmatico di aminoacidi derivati dalla digestione delle proteine, soprattutto di leucina, valiana, isoleucina e arginina, stimola la secrezione di ormoni (tutti proteici) iperglicemizzanti quali glucagone, ormone della crescita e relativo fattore di crescita insulino-simile.
Questi ormoni a loro volta stimolano la secrezione di insulina con cui sinergicamente stivano gli aminoacidi nelle cellule e li rendono disponibili per le sintesi proteiche.
Al contrario l’insulina secreta in risposta all’aumento della glicemia in seguito ad assunzione glucidica, diventa antagonista di questi ormoni, poiché la sua azione in questa situazione metabolica è fortemente ipoglicemizzante.
SINTESI DELLE PROTEINE
La biosintesi delle proteine è sulla bocca di tutti, ma come in ogni aspetto della vita, sono tutti f… con il nucleo degli altri (sul nucleo ci torno dopo).
“Assumere leucina per stimolare la sintesi proteica; insulina, carboidrati si, carboidrati no, picchi di cortisolo, abbassare il cortisolo”…
La sintesi delle proteine nei procarioti procede al ritmo di un aminoacido al secondo.
Negli eucarioti si conosce un po’ meno, ma è evidente che indipendentemente dallo stato energetico e dalla situazione endocrina dell’organismo, questa si verifica sempre e comunque attraverso meccanismi evolutivi indipendenti dalle operazioni di marketing.
La sintesi proteica avviene nel nucleo di tutte le cellule, sede del DNA, macromolecola che contiene l’informazione genetica racchiusa nel codice dato dal susseguirsi delle basi azotate.
Il DNA non può uscire dal nucleo cellulare, ma le biosintesi si svolgono nel citosol. Per questo motivo all’interno del nucleo si forma mRNA (messaggero), molecola che trascrive l’informazione genica del DNA, copiando correttamente la sequenza di basi azotate che codificano i vari aminoacidi.
L’mRNA esce dal nucleo e quando incontra i ribosomi, traduce il messaggio ed inizia la sintesi proteica.
Il ribosoma è un complesso di due unità. Una si lega sopra l’mRNA, l’altra sotto.
L’unità superiore legge le triplette di basi che codificano uno specifico aminoacido, quella sotto accoglie in un sito specifico gli aminoacidi che nel frattempo vengono richiamati in sede, li lega tra loro attraverso il legame peptidico idrolizzando ATP e li fa uscire da un altro sito della subunità inferiore del ribosoma sotto forma di catena peptidica.
Gli aminoacidi per giungere al ribosoma devono prima essere attivati legandosi ad un tRNA (di trasporto).
Questo processo avviene grazie ad un enzima caratterizzato da tre siti. In un sito viene accolto l’aminoacido, in un altro il tRNA e nell’ultimo l’ATP, che reagisce con l’aminoacido che si lega all’adenina, dopo che l’ATP ha rilasciato entrambi i gruppi fosfato.
L’ultimo passaggio avviene tramite l’intervento del t-RNA che dal suo sito, attraverso la sua adenina, scaccia l’adenina dell’ATP legandosi all’aminoacido e lasciando l’enzima per dirigersi al ribosoma.
SMALTIMENTO PROTEINE E CONSUMI ENERGETICI
Mai sentito parlare dell’effetto termogenico delle proteine?
La molecola di ATP dona i gruppi fostato per qualunque cosa nell’organismo, veramente qualunque cosa.
Per una descrizione più approfondita della molecola di APT cliccare sul link CRESCITA MUSCOLARE. TUTTA QUESTIONE DI INCANALARE L’ENERGIA
Come si può ben capire, la sintesi proteica richiede l’impiego di energia sotto forma di ATP dall’inizio alla fine e lo stesso vale per lo smaltimento dell’azoto sotto forma di ammoniaca con il ciclo dell’urea.
Il ciclo dell’urea ha infatti un elevato costo energetico per la cellula consumando molto ATP.
Brevemente descrivo come si svolge;
anidride carbonica, ammoniaca e ornitina vengono utilizzate per sintetizzare citrullina, che a sua volta si lega all’aspartato per formare argininosuccinato.
Questo composto viene scisso in fumarato e arginina.
L’arginina rilascia una porzione della sua stessa molecola, l’urea e si converte in ornitina che ritorna in funzione del ciclo.
Il fumarato, invece, viene trasformato in ossalacetato nel ciclo di Krebs, recuperando ATP e quindi parzialmente il costo energetico del ciclo.
Da notare che arginina e aspartato sono aminoacidi e l’ornitina è l’arginina deaminata.
CONCLUDENDO
Gli aminoacidi nell’organismo hanno molteplici ruoli, quindi è ovvio che ricondurli alla “semplice” funzione plastica limita molto la comprensione olistica dei loro effetti e orienta le menti verso la convinzione paradigmatica riguardo la loro azione a senso unico nel corpo, e quando la conseguente assunzione tramite gli alimenti e l’eventuale integrazione è figlia di incomprensione, aumentano tantissimo gli sprechi, che si contrappongono ad altrettanto importanti vie metaboliche.
Ad majora…
di Scilipoti Nino